In December 2019, several cases of pneumonia of unknown origin were reported in Wuhan, China. The causative agent was characterized as a novel coronavirus, initially referred to as 2019-nCoV and renamed severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2) (Zhou et al., 2020b). This respiratory illness, coronavirus disease 2019 (COVID-19), has spread rapidly by human-to-human transmission, caused major outbreaks worldwide, and resulted in considerable morbidity and mortality. On March 11, 2020, WHO classified COVID-19 as a pandemic. It has stressed health systems and the global economy, as governments balance prevention, clinical care, and socioeconomic challenges.
Virology and Immunology
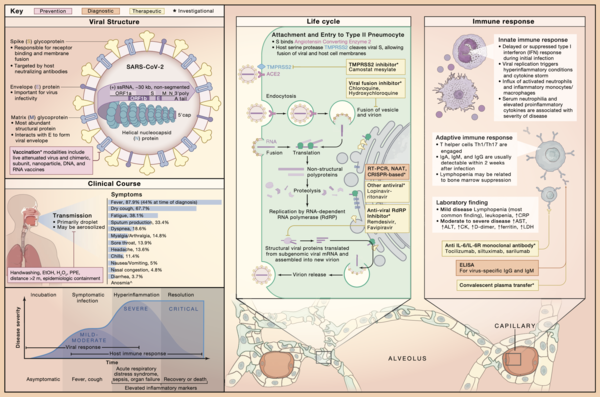
Classified in the Coronaviridae family and betacoronavirus genus, SARS-CoV-2 is the seventh coronavirus known to infect humans. Coronaviruses are enveloped positive- sense, single-stranded RNA viruses with mammalian and avian hosts. Human coronaviruses include 229E, NL63, OC43, and HKU1, which are associated with mild seasonal illness, as well as viruses responsible for past outbreaks of severe acute respiratory syndrome (SARS) and Middle East respiratory syndrome (MERS). Genetic analyses impli- cate bats as a natural reservoir of coronaviruses and other animals as potential intermediate hosts in the emergence of SARS-CoV-2 (Andersen et al., 2020).
The SARS-CoV-2 30 kb genome encodes proteases and an RNA-dependent RNA polymerase (RdRp) as well as several structural proteins. The SARS-CoV-2 virion is com- posed of a helical capsid formed by nucleocapsid (N) proteins bound to the RNA genome and an envelope made up of membrane (M) and envelope (E) proteins, coated with trimeric spike (S) proteins (Zhou et al., 2020b). The S protein binds to the ACE2 enzyme on the plasma membrane of type 2 pneumocytes and intestinal epithelial cells. After binding, the S protein is cleaved by a host membrane serine protease, TMPRSS2, facilitating viral entry (Hoffmann et al., 2020).
Based on our understanding of SARS and MERS, and their similarity to COVID-19, the human immune response in mild cases is likely characterized by a robust type I interferon antiviral response and CD4+ Th1 and CD8+ T cell response, resulting in viral clearance. In severe cases, there is likely an initial delay in the antiviral response and subsequently increased production of inflammatory cytokines with an influx of monocytes and neutrophils into the lung, leading to cytokine storm syndrome. These cytokines, including interleukin (IL)-1, IL-6, IL-12, and tumor necrosis factor-α, lead to increased vascular permeability and may contribute to respiratory failure (Prompetchara et al., 2020). Another hallmark of severe disease is lymphopenia, which may be due to direct infection of lymphocytes or suppression of bone marrow by the antiviral response. Neutralizing IgM and IgG antibodies to SARS-CoV-2 can be detected within 2 weeks of infection; it is still unknown whether patients are protected from reinfection (Wölfel et al.., 2020; Prompetchara et al., 2020).
Transmission and Clinical Course
SARS-CoV-2 is thought to spread primarily via respiratory droplet and fomite transmission, although the possibility of fecal-oral transmission is being investigated (Wölfel et al., 2020). It can spread over longer distances when aerosolized. Once infection is established, the clinical course of COVID-19 is variable, making both case identification and triage difficult. Notably, asymptomatic and presymptomatic transmission has been described. For those who become symptomatic, the incubation period, the time from exposure to symptom onset, is 4-5 days on average (Li et al., 2020). The most common symptoms include cough, fever, and fatigue. For a minority of patients, the disease worsens approximately 5-10 days after symptom onset, resulting in complications such as acute respiratory distress syndrome (ARDS) and other end organ failure (Zhou et al., 2020a). Patients over 60 and those with comorbid conditions, including cardiovascular disease, underlying respiratory conditions, and cancer, are at higher risk for these severe complications and death. In comparison, children have a milder clinical course (CDC, 2020).
Diagnosis and Management
Reverse transcriptase-polymerase chain reaction of respiratory samples remains the gold standard for diagnosing COVID-19, though immunoassays, isothermal nucleic acid amplification tests, and CRISPR-based diagnostic tests are in development to facilitate rapid point-of-care testing and address global testing shortages (Pang et al., 2020). Among those diagnosed, common laboratory findings include lymphopenia, elevated markers of inflammation including C-reactive protein, and elevated markers of coagulation cascade activation including D-dimer; higher viral load and inflammatory marker levels correlate with increased disease severity. Chest computed tomography (CT) scans of symptomatic patients are sensitive for detecting disease but nonspecific (CDC, 2020).
The current management of COVID-19 is focused on infection control, supportive care including ventilatory support as needed, and treatment of sequelae and complica- tions. Patients with suspected COVID-19 who are asymptomatic or mildly ill are recommended to self-isolate for 2 weeks from the day of exposure, use acetaminophen as needed, remain hydrated, and monitor for worsening symptoms. Patients with more severe disease are admitted to the hospital for treatment of hypoxia, respiratory failure, ARDS, and septic shock.
Investigational Therapies and Vaccine Development
Multiple clinical trials are underway to define potential roles for antiviral agents and specific immunomodulators. Antiviral agents under investigation include inhibitors endosome maturation (hydroxychloroquine), inhibitors of viral RNA-dependent RNA polymerase (remdesivir, favipiravir) and inhibitors of viral protein synthesis and matura- tion (lopinavir/ritonavir); immunomodulators under investigation include interferon-β and blockade of IL-6 receptor or IL-6 (tocilizumab, siltuximab, sarilumab) (McCreary and Pogue, 2020). Passive immunization with convalescent plasma and active immunization strategies involving live-attenuated virus, chimeric virus, subunit, nanoparticle, RNA, and DNA are in development and testing. As the field looks toward the future of COVID-19 therapy, temporality of treatment should be considered, as some therapies could show greater efficacy at different disease stages.
スナップショット: COVID-19 (Cell 2020.04.29)
2019年12月、中国の武漢で原因不明の肺炎の数例が報告された。原因は、当初2019-nCoVと呼ばれ、重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)と改名された新型コロナウイルスとして特徴づけられた(Zhouら) 。この呼吸器疾患であるコロナウイルス疾患2019(COVID-19)は、ヒトからヒトへの感染によって急速に広がり、世界中で大規模なアウトブレイクを引き起こし、顕著な罹患率および死亡率をもたらした。2020年3月11日、WHOはCOVID-19をパンデミックに分類した。COVID-19は、政府が予防、臨床ケア、社会経済的課題のバランスをとる中で、健康システムと世界経済にストレスを与えている。
・ウイルス学と免疫学
SARS-CoV-2は、コロナウイルス科およびベータコロナウイルス属に分類され、ヒトに感染することが知られている7番目のコロナウイルスである。コロナウイルスは、哺乳類および鳥類を宿主とするエンベロープ型のポジティブセンス一本鎖RNAウイルスである。ヒトのコロナウイルスには 229E、NL63、OC43、HKU1 などがあり、これらは軽度の季節性疾患と関連しているほか、過去に発生した重症急性呼吸器症候群(SARS)や中東呼吸器症候群(MERS)の原因となったウイルスも含まれている。遺伝子解析により、コウモリがコロナウイルスの自然な貯蔵庫であり、他の動物がSARS-CoV-2の出現における中間宿主となる可能性があることが示唆されている(Andersenら)。
SARS-CoV-2の30kbゲノムは、プロテアーゼおよびRNA依存性RNAポリメラーゼ(RdRp)、ならびにいくつかの構造タンパク質をコードしている。SARS-CoV-2ウイルスは、RNAゲノムに結合したヌクレオキャプシド(N)タンパク質によって形成されたらせん状のキャプシドと、膜(M)タンパク質とエンベロープ(E)タンパク質からなるエンベロープを3量体のスパイク(S)タンパク質で被覆したもので構成されている(Zhouら、2020年)Sタンパク質は、2型肺細胞や腸管上皮細胞の形質膜上のACE2酵素に結合する。結合後、Sタンパク質は、宿主膜セリンプロテアーゼであるTMPRSS2によって切断され、ウイルスの侵入を促進する(Hoffmannら)。
SARSおよびMERSの理解、およびCOVID-19との類似性に基づいて、軽症例におけるヒト免疫応答は、おそらく、強いI型インターフェロン抗ウイルス応答およびCD4+Th1およびCD8+T細胞応答が特徴で、その結果、ウイルスクリアランスが生じる。重症の場合は、抗ウイルス反応の初期遅延があり、その後、単球および好中球の肺への流入を伴う炎症性サイトカインの産生が増加し、サイトカインストーム症候群を引き起こす可能性がある。インターロイキン(IL)-1、IL-6、IL-12、およびTNF-αを含むこれらのサイトカインは、血管透過性亢進をもたらし、呼吸不全に寄与する可能性がある(Prompetcharaら)。重症化のもう一つの特徴はリンパ球減少であり、これはリンパ球の直接感染または抗ウイルス反応による骨髄抑制に起因する可能性がある。SARS-CoV-2に対する中和性IgM抗体およびIgG抗体は、感染後2週間以内に検出され得る;患者が再感染から保護されるかどうかはまだ不明である(Wölfelら、Prompetcharaら)。
・感染および臨床経過
SARS-CoV-2は、主に呼吸器飛沫感染と媒介物を介して広がると考えられているが、糞便感染の可能性も調査されている(Wölfelら)。エアロゾル化された場合には、より長い距離で拡散する可能性がある。感染が確立されると、COVID-19の臨床経過は変化に富み、症例の特定とトリアージの両方が困難になる。特筆すべきは、無症候性および無症候性の感染が報告されていることである。症状を呈するようになった人の場合、曝露から症状発現までの潜伏期間、すなわち潜伏期間は平均で4~5日である(Liら)。最も一般的な症状は、咳、発熱、倦怠感などである。少数の患者では、症状発現後約5〜10日後に病状が悪化し、急性呼吸窮迫症候群(ARDS)および他の臓器不全などの合併症を引き起こす(Zhouら)。60歳以上の患者や、心血管疾患、呼吸器疾患、がんなどの併存疾患を有する患者は、これらの重篤な合併症や死亡のリスクが高い。一方、小児では臨床経過は軽度である(CDC)。
・診断と管理
呼吸器検体のRT-PCRは、COVID-19を診断するためのゴールドスタンダードであり続けているが、イムノアッセイ、等温核酸増幅試験、およびCRISPRベースの診断検査は、迅速なポイントオブケア検査を促進し、世界的な検査不足に対処するために開発されている(Pangら)。診断された患者の中で、一般的な臨床検査所見には、リンパ球減少、CRPを含む炎症マーカーの上昇、Dダイマーを含む凝固カスケード活性化マーカーの上昇が含まれる;ウイルス負荷および炎症マーカーレベルの上昇は、疾患の重症度の増加と相関している。症状のある患者の胸部コンピュータ断層撮影(CT)スキャンは、疾患の検出には感度が高いが、非特異的である(CDC)。
COVID-19の現在の管理は、感染管理、必要に応じた人工呼吸器のサポートを含む支持療法、後遺症や合併症の治療に重点が置かれている。COVID-19が疑われる患者で、無症状または軽症の場合は、曝露した日から2週間は自己隔離し、必要に応じてアセトアミノフェンを使用し、水分補給を継続し、症状の悪化を監視することが推奨されている。より重症の患者は、低酸素症、呼吸不全、ARDS、敗血症性ショックの治療のために入院する。
・治験薬とワクチン開発
抗ウイルス薬と特異的免疫調節薬の潜在的な役割を明らかにするために、複数の臨床試験が進行中である。検討中の抗ウイルス剤には、エンドソーム成熟化阻害剤(ヒドロキシクロロキン)、ウイルスRNA依存性RNAポリメラーゼ阻害剤(レムデシビル、ファビピラビル)、およびウイルスタンパク質合成および成熟化阻害剤(ロピナビル/リトナビル)が含まれる。検討中の免疫調節剤には、インターフェロン-βおよびIL-6受容体またはIL-6の遮断剤(トシリズマブ、シルツキシマブ、サリルマブ)が含まれる(McCreary and Pogue)。回復期血漿を用いた受動的免疫化およびライブアッテネイトウイルス、キメラウイルス、サブユニット、ナノ粒子、RNAおよびDNAを含む能動的免疫化戦略が開発および試験中である。この分野では、COVID-19治療の将来に向けて、治療法によっては、異なる疾患ステージでより大きな効果を示す可能性があるため、治療の時間的経過を考慮する必要がある。
(Smart119 スタッフ コメント)
世界的医学雑誌「Cell」のまとめ。見やすい図が特徴です。興味ある方は原文をご確認ください。