Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection carries a substantial risk of severe and prolonged illness; treatment options are currently limited. We assessed the efficacy and safety of inhaled nebulised interferon beta-1a (SNG001) for the treatment of patients admitted to hospital with COVID-19.
We did a randomised, double-blind, placebo-controlled, phase 2 pilot trial at nine UK sites. Adults aged 18 years or older and admitted to hospital with COVID-19 symptoms, with a positive RT-PCR or point-of-care test, or both, were randomly assigned (1:1) to receive SNG001 (6 MIU) or placebo by inhalation via a mouthpiece daily for 14 days. The primary outcome was the change in clinical condition on the WHO Ordinal Scale for Clinical Improvement (OSCI) during the dosing period in the intention-to-treat population (all randomised patients who received at least one dose of the study drug). The OSCI is a 9-point scale, where 0 corresponds to no infection and 8 corresponds to death. Multiple analyses were done to identify the most suitable statistical method for future clinical trials. Safety was assessed by monitoring adverse events for 28 days. This trial is registered with Clinicaltrialsregister.eu (2020-001023-14) and ClinicalTrials.gov (NCT04385095); the pilot trial of inpatients with COVID-19 is now completed.
Between March 30 and May 30, 2020, 101 patients were randomly assigned to SNG001 (n=50) or placebo (n=51). 48 received SNG001 and 50 received placebo and were included in the intention-to-treat population. 66 (67%) patients required oxygen supplementation at baseline: 29 in the placebo group and 37 in the SNG001 group. Patients receiving SNG001 had greater odds of improvement on the OSCI scale (odds ratio 2·32 [95% CI 1·07-5·04]; p=0·033) on day 15 or 16 and were more likely than those receiving placebo to recover to an OSCI score of 1 (no limitation of activities) during treatment (hazard ratio 2·19 [95% CI 1·03-4·69]; p=0·043). SNG001 was well tolerated. The most frequently reported treatment-emergent adverse event was headache (seven [15%] patients in the SNG001 group and five [10%] in the placebo group). There were three deaths in the placebo group and none in the SNG001 group.
Patients who received SNG001 had greater odds of improvement and recovered more rapidly from SARS-CoV-2 infection than patients who received placebo, providing a strong rationale for further trials.
SARS-CoV-2感染は、重症化と長期化の大きなリスクを伴い、現在のところ治療法の選択肢は限られている。我々は、COVID-19で入院した患者に対する吸入式ネブライズドインターフェロンβ-1a(SNG001)の有効性と安全性を評価した。
英国の9施設で無作為化二重盲検プラセボ対照第2相パイロット試験を実施した。18歳以上の成人でCOVID-19の症状があり、RT-PCR検査またはポイントオブケア検査が陽性、またはその両方が陽性で入院した患者を対象に、SNG001(6MIU)またはプラセボをマウスピースから毎日14日間吸入する群に無作為に割り付けた(1:1)。主要アウトカムは、意図的治療対象集団(試験薬を少なくとも1回投与されたすべての無作為化患者)における投与期間中のWHO Ordinal Scale for Clinical Improvement(OSCI)における臨床状態の変化であった。OSCIは9点満点のスケールで、0が感染なし、8が死亡に相当する。今後の臨床試験に最も適した統計的手法を特定するために、複数の解析を行った。安全性は28日間の有害事象のモニタリングにより評価した。この試験はClinicaltrialsregister.eu(2020-001023-14)およびClinicalTrials.gov(NCT04385095)に登録されている;COVID-19を有する入院患者を対象としたパイロット試験は現在終了している。
2020年3月30日から5月30日までの間に、101人の患者をSNG001(n=50)またはプラセボ(n=51)に無作為に割り付けた。48人がSNG001を受け、50人がプラセボを受け、意図的治療集団に含まれた。66人(67%)の患者がベースライン時に酸素補給を必要とした:プラセボ群で29人、SNG001群で37人であった。SNG001を投与された患者は、15日目または16日目にOSCI尺度で改善する確率が高く(オッズ比2-32 [95%CI 1-07-5-04]; p=0-033)、プラセボを投与された患者よりも治療中にOSCIスコアが1(活動制限なし)に回復する可能性が高かった(ハザード比2-19 [95%CI 1-03-4-69]; p=0-043)。SNG001の忍容性は良好であった。最も頻繁に報告された治療上の有害事象は頭痛であった(SNG001群では7例[15%]、プラセボ群では5例[10%])。死亡例はプラセボ群で3例、SNG001群では1例もなかった。
SNG001を投与された患者は、プラセボを投与された患者に比べて、SARS-CoV-2感染症の改善のオッズが高く、より迅速に回復したことから、さらなる試験が必要とされる強い根拠となった。
図:試験期間中の患者の回復度(OSCI≦1)
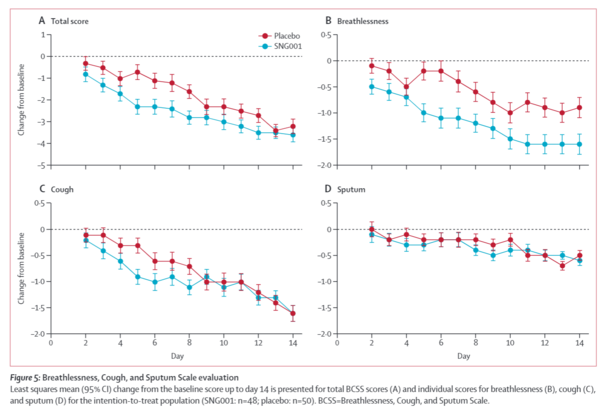
意図的治療集団(SNG001:n=48、プラセボ:n=50)について、ベースラインスコアから14日目までの最小二乗平均(95%CI)変化を、BCSSの総スコア(A)および息切れ(B)、咳(C)、喀痰(D)の個別スコアについて示した。BCSS=Breathlessness, Cough, and Sputum Scale。
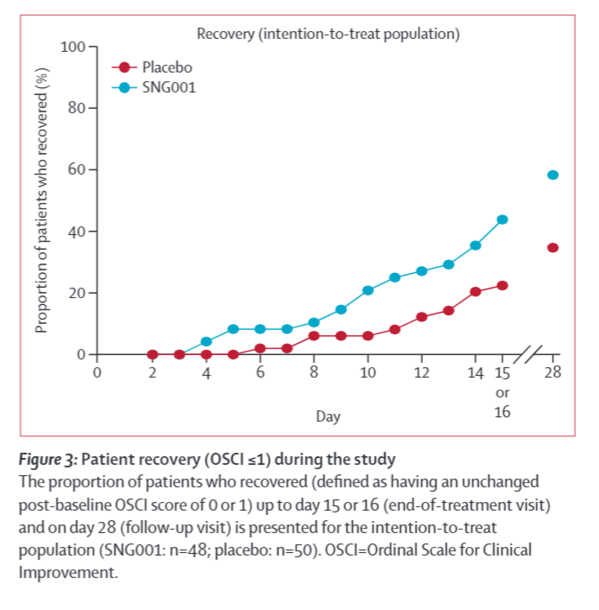
図:息切れ・咳・痰のスケール評価
意図的治療集団(SNG001:n=48、プラセボ:n=50)について、15日目または16日目(治療終了時の訪問)までおよび28日目(フォローアップ訪問)までに回復した患者の割合(ベースライン後のOSCIスコアが0または1から変化がなかったと定義)を示す。OSCI=Ordinal Scale for Clinical Improvement。
https://www.thelancet.com/journals/lanres/article/PIIS2213-2600(20)30511-7/fulltext