Background:
A vaccine to protect against COVID-19 is urgently needed. We aimed to assess the safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 (Ad5) vectored COVID-19 vaccine expressing the spike glycoprotein of a severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) strain.
Methods:
We did a dose-escalation, single-centre, open-label, non-randomised, phase 1 trial of an Ad5 vectored COVID-19 vaccine in Wuhan, China. Healthy adults aged between 18 and 60 years were sequentially enrolled and allocated to one of three dose groups (5 × 1010, 1 × 1011, and 1·5 × 1011 viral particles) to receive an intramuscular injection of vaccine. The primary outcome was adverse events in the 7 days post-vaccination. Safety was assessed over 28 days post-vaccination. Specific antibodies were measured with ELISA, and the neutralising antibody responses induced by vaccination were detected with SARS-CoV-2 virus neutralisation and pseudovirus neutralisation tests. T-cell responses were assessed by enzyme-linked immunospot and flow-cytometry assays. This study is registered with ClinicalTrials.gov, NCT04313127.
Findings:
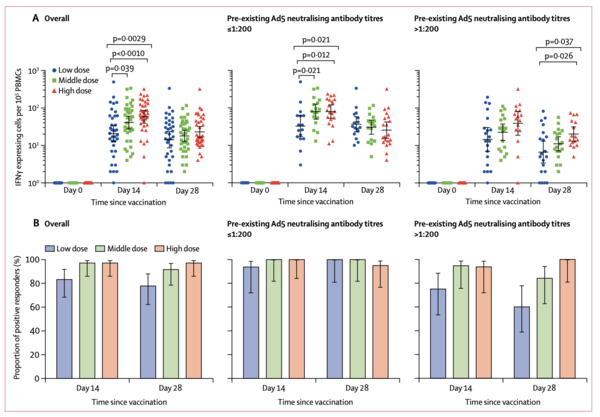
Between March 16 and March 27, 2020, we screened 195 individuals for eligibility. Of them, 108 participants (51% male, 49% female; mean age 36·3 years) were recruited and received the low dose (n=36), middle dose (n=36), or high dose (n=36) of the vaccine. All enrolled participants were included in the analysis. At least one adverse reaction within the first 7 days after the vaccination was reported in 30 (83%) participants in the low dose group, 30 (83%) participants in the middle dose group, and 27 (75%) participants in the high dose group. The most common injection site adverse reaction was pain, which was reported in 58 (54%) vaccine recipients, and the most commonly reported systematic adverse reactions were fever (50 [46%]), fatigue (47 [44%]), headache (42 [39%]), and muscle pain (18 [17%]. Most adverse reactions that were reported in all dose groups were mild or moderate in severity. No serious adverse event was noted within 28 days post-vaccination. ELISA antibodies and neutralising antibodies increased significantly at day 14, and peaked 28 days post-vaccination. Specific T-cell response peaked at day 14 post-vaccination.
Interpretation:
The Ad5 vectored COVID-19 vaccine is tolerable and immunogenic at 28 days post-vaccination. Humoral responses against SARS-CoV-2 peaked at day 28 post-vaccination in healthy adults, and rapid specific T-cell responses were noted from day 14 post-vaccination. Our findings suggest that the Ad5 vectored COVID-19 vaccine warrants further investigation.
組換えアデノウイルス5型ベクター化COVID-19ワクチンの安全性、忍容性、免疫原性:用量エスカレーション、オープンラベル、非ランダム化、ヒト初試験(Lancet, 2020.05.22)
背景
COVID-19 に対するワクチンの開発が急務となっている。我々は,重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)株のスパイク糖タンパク質を発現する組換えアデノウイルス5型(Ad5)ベクター化COVID-19ワクチンの安全性、忍容性、免疫原性を評価することを目的とした。
方法
中国・武漢市において、Ad5 ベクター化 COVID-19 ワクチンの用量漸増、単施設、非盲検、無作為化、第 1 相試験を実施した。18~60歳の健康な成人を順次登録し、3つの用量群(5×1010、1×1011、1~5×1011のウイルス粒子)のいずれかに割り付け、ワクチンの筋肉内注射を実施した。主要転帰はワクチン接種後7日間の有害事象とした。安全性はワクチン接種後 28 日間にわたって評価した。特異抗体はELISAで測定し、ワクチン接種により誘発される中和抗体反応はSARS-CoV-2ウイルス中和試験およびシュードウイルス中和試験で検出した。T 細胞応答は、酵素結合免疫スポットおよびフローサイトメトリーアッセイによって評価した。この研究は ClinicalTrials.gov, NCT04313127 に登録されている。
結果
3月16日から2020年3月27日までの間に、195人をスクリーニングし、108人(男性51%、女性49%、平均年齢36~3歳)の参加者を募集し、低用量(n=36)、中用量(n=36)、または高用量(n=36)のワクチンを接種した。登録されたすべての参加者が解析に含まれた。ワクチン接種後7日以内に少なくとも1回の副作用が報告されたのは、低用量群で30人(83%)、中用量群で30人(83%)、高用量群で27人(75%)であった。注射部位の副作用で最も多かったのは痛みで、58人(54%)のワクチン接種者で報告され、全身性の副作用で最も多かったのは発熱(50[46%])、倦怠感(47[44%])、頭痛(42[39%])、筋肉痛(18[17%])であった。すべての用量群で報告されたほとんどの有害事象は、重症度が軽度または中等度であった。ワクチン接種後 28 日以内の重篤な有害事象は認められなかった。ELISA抗体および中和抗体は14日目に有意に増加し、接種後28日目にピークを迎えた。特異的T細胞反応はワクチン接種後14日目にピークを迎えた。
解釈
Ad5ベクター化COVID-19ワクチンは、ワクチン接種後28日目に忍容性と免疫原性を示している。健康成人のSARS-CoV-2に対する体液性反応はワクチン接種後28日目にピークを迎え、ワクチン接種後14日目から急速な特異的T細胞反応が認められた。以上の結果から,Ad5ベクター化COVID-19ワクチンはさらなる研究の必要性が示唆された。
(Smart119スタッフコメント)
COVID19ワクチンのヒトを対象とした初報告(第1相試験)。
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31208-3/fulltext