Abstract
BACKGROUND
The severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) emerged in late 2019 and spread globally, prompting an international effort to accelerate development of a vaccine. The candidate vaccine mRNA-1273 encodes the stabilized prefusion SARS-CoV-2 spike protein.
METHODS
We conducted a phase 1, dose-escalation, open-label trial including 45 healthy adults, 18 to 55 years of age, who received two vaccinations, 28 days apart, with mRNA-1273 in a dose of 25 μg, 100 μg, or 250 μg. There were 15 participants in each dose group.
RESULTS
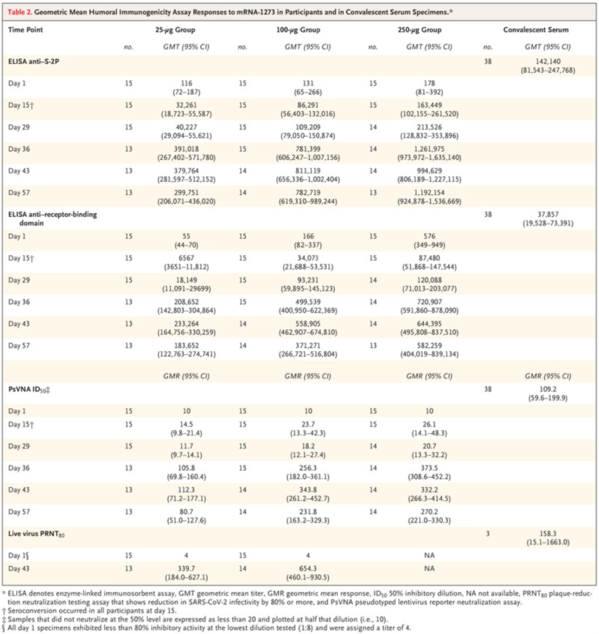
After the first vaccination, antibody responses were higher with higher dose (day 29 enzyme-linked immunosorbent assay anti-S-2P antibody geometric mean titer [GMT], 40,227 in the 25-μg group, 109,209 in the 100-μg group, and 213,526 in the 250-μg group). After the second vaccination, the titers increased (day 57 GMT, 299,751, 782,719, and 1,192,154, respectively). After the second vaccination, serum-neutralizing activity was detected by two methods in all participants evaluated, with values generally similar to those in the upper half of the distribution of a panel of control convalescent serum specimens. Solicited adverse events that occurred in more than half the participants included fatigue, chills, headache, myalgia, and pain at the injection site. Systemic adverse events were more common after the second vaccination, particularly with the highest dose, and three participants (21%) in the 250-μg dose group reported one or more severe adverse events.
CONCLUSIONS
The mRNA-1273 vaccine induced anti-SARS-CoV-2 immune responses in all participants, and no trial-limiting safety concerns were identified. These findings support further development of this vaccine.
SARS-CoV-2に対するmRNAワクチン --速報 (N Eng J Med. 2020.07.14)
概要
背景
SARS-CoV-2は2019年後半に出現し、世界的に広がり、ワクチン開発を加速する国際的な取り組みが促されている。ワクチンの候補であるmRNA-1273は、安定化した前駆体SARS-CoV-2スパイクタンパク質をコードしている。
方法
我々は、第 1 相の、用量漸増、オープンラベル試験を実施した。この試験では、健康な成人(18~55 歳) 45 名を対象に、mRNA-1273 のワクチン接種を 28 日間隔で 2 回、25 μg、100 μg、250 μg の投与量で投与した。各投与群には15人の参加者がいた。
結果
1回目のワクチン接種後は、投与量が多いほど抗体反応が高くなった(29日目の酵素結合免疫吸着アッセイ(ELISA)による抗S-2P抗体幾何平均抗体価[GMT]は、25μg群40,227、100μg群109,209、250μg群213,526)。2回目のワクチン接種後、力価は上昇した(57日目のGMTは、各299,751、782,719、1,192,154)。2回目のワクチン接種後、2つの方法(PsVNAとPRNT)で評価された血清中和活性はすべての参加者で検出され、その値はコントロールである回復期血清検体の検査値の分布の上位2分の1の値と類似していた。有害事象は半数以上の参加者に認められ、疲労、悪寒、頭痛、筋肉痛、注射部位の痛みが含まれていた。全身性の有害事象は2回目のワクチン接種後、特に最高用量の接種でより多く見られ、250μg投与群の3人の参加者(21%)が1つまたはそれ以上の重篤な有害事象を報告した。
結論
mRNA-1273ワクチンは全参加者に抗SARS-CoV-2免疫反応を誘導し、試験を制限するような安全性に関する懸念は認められなかった。これらの知見は、このワクチンのさらなる開発を支持するものである。
Figure1. Systemic and Local Adverse Events.
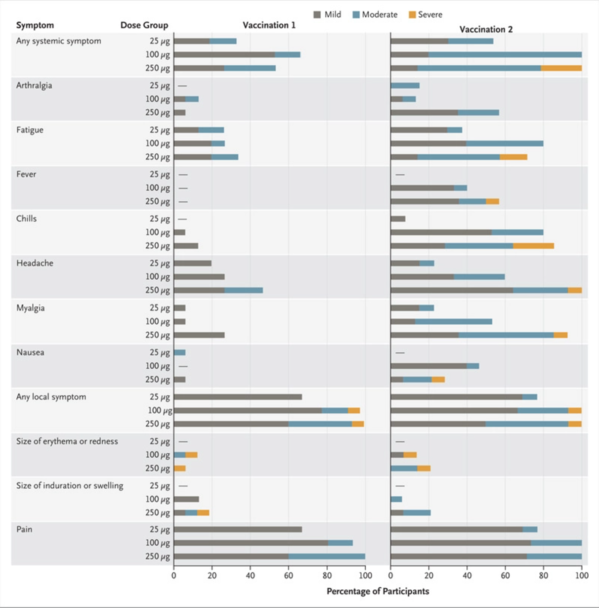
Table2. Geometric Mean Humoral Immunogenicity Assay Responses to mRNA-1273 in Participants and in Convalescent Serum Specimens.
https://www.nejm.org/doi/full/10.1056/NEJMoa2022483?query=RP