Testing of vaccine candidates to prevent infection with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in an older population is important, since increased incidences of illness and death from coronavirus disease 2019 (Covid-19) have been associated with an older age.
We conducted a phase 1, dose-escalation, open-label trial of a messenger RNA vaccine, mRNA-1273, which encodes the stabilized prefusion SARS-CoV-2 spike protein (S-2P) in healthy adults. The trial was expanded to include 40 older adults, who were stratified according to age (56 to 70 years or ≥71 years). All the participants were assigned sequentially to receive two doses of either 25 μg or 100 μg of vaccine administered 28 days apart.
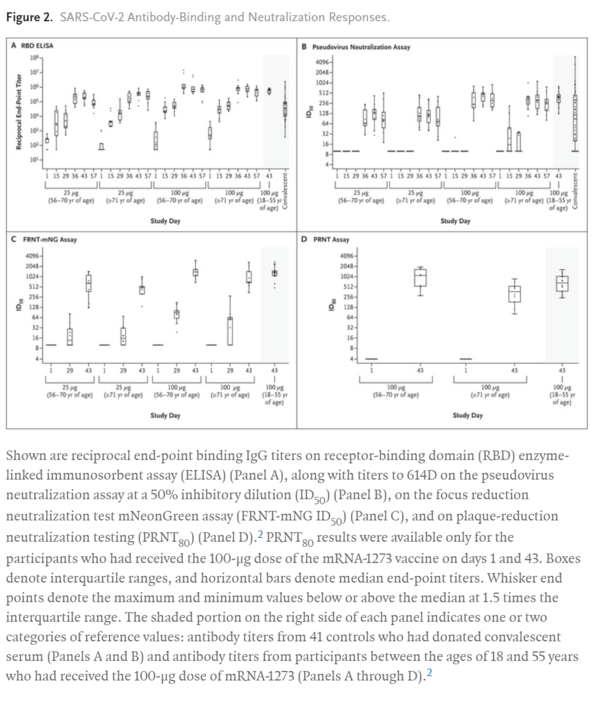
Solicited adverse events were predominantly mild or moderate in severity and most frequently included fatigue, chills, headache, myalgia, and pain at the injection site. Such adverse events were dose-dependent and were more common after the second immunization. Binding-antibody responses increased rapidly after the first immunization. By day 57, among the participants who received the 25-μg dose, the anti-S-2P geometric mean titer (GMT) was 323,945 among those between the ages of 56 and 70 years and 1,128,391 among those who were 71 years of age or older; among the participants who received the 100-μg dose, the GMT in the two age subgroups was 1,183,066 and 3,638,522, respectively. After the second immunization, serum neutralizing activity was detected in all the participants by multiple methods. Binding- and neutralizing-antibody responses appeared to be similar to those previously reported among vaccine recipients between the ages of 18 and 55 years and were above the median of a panel of controls who had donated convalescent serum. The vaccine elicited a strong CD4 cytokine response involving type 1 helper T cells.
In this small study involving older adults, adverse events associated with the mRNA-1273 vaccine were mainly mild or moderate. The 100-μg dose induced higher binding- and neutralizing-antibody titers than the 25-μg dose, which supports the use of the 100-μg dose in a phase 3 vaccine trial.
Covid-19による罹患率と死亡率の増加が高齢者と関連していることから、高齢者集団におけるSARS-CoV-2への感染を予防するためのワクチン候補の試験は重要である。
我々は,健康な成人を対象に,安定化した前駆体 SARS-CoV-2 スパイクタンパク質(S-2P)をコードするメッセンジャー RNA ワクチン、 mRNA-1273 の第 1 相用量漸増オープンラベル試験を実施した。この試験は、年齢(56~70歳または≧71歳)に応じて層別化された40人の高齢者を対象に拡大された。すべての参加者は、28日間隔で25μgまたは100μgのワクチンを2回接種するように順次割り付けられた。
有害事象は主に軽度または中等度の重症度で、最も頻繁に発生したのは疲労、悪寒、頭痛、筋肉痛、注射部位の疼痛であった。このような有害事象は用量依存性があり、2回目の接種後により一般的であった。抗体の結合反応は初回接種後に急速に増加した。57日目までに、25μgを投与された参加者の抗S-2P幾何学的平均力価(GMT)は56~70歳で323,945、71歳以上で1,128,391であった;100μgを投与された参加者の2つの年齢サブグループのGMTはそれぞれ1,183,066および3,638,522であった。2回目の接種後、血清中和活性が全参加者で複数の方法で検出された。抗体の結合反応および中和反応は、18歳から55歳までのワクチン接種者の間で以前に報告されたものと類似しており、回復期の血清を提供した対照群の中央値を上回っていた。ワクチンは1型ヘルパーT細胞を含む強力なCD4サイトカイン反応を誘発した。
高齢者を対象としたこの小規模試験では、mRNA-1273 ワクチンに関連する有害事象は主に軽度または中等度であった。100μg投与では、25μg投与よりも高い結合抗体価および中和抗体価が誘導され、第3相ワクチン試験での100μg投与を支持する結果となった。

https://www.nejm.org/doi/full/10.1056/NEJMoa2028436?query=RP#figures_media